細胞間コミュニケーション関連テーマ
研究テーマ一覧へ戻る1. がん細胞の細胞間コミュニケーション
がん細胞は置かれた環境に応じて性質を変え、生存する能力に長けています。周辺の状況を敏感に察知するセンサー(細胞表面分子の発達)、その環境に潜伏する順応性(周辺細胞との相互作用)、そして自身をリプログラムする特異的な機構の発達がそれを可能にすると考えられます。さらに、変貌していくがん細胞に接触する周辺細胞も次第に様相を変え、がん増悪に寄与する可能性があります。
細胞間結合Gap Junction(GJ)の関わる微小環境調節
細胞間結合の一様式であるGJはイオンチャネルとしても機能します。つまり、隣接細胞間の細胞質成分がGJを透過して直接行き来することができます。GJを構成するコネキシン(connexin; Cx)タンパク質は6量体を形成して細胞膜へ移動し、片側チャネル(ヘミチャネル)を作ります。さらに隣接細胞間のヘミチャネル同士が結合することでGJを成し、細胞間を貫くチャネルとなります(Fig. 1A)。GJを透過できる分子はグルコースやグルタミン酸などの栄養成分のほか、Ca2+, ATP,およびcAMPなど情報伝達シグナル分子についても実証されています。Cxはヒトで21の分子種が同定されています。全身の細胞で普遍的に存在する一方で、組織ごとにみると2~3種の分子種がメインに発現・機能し、時空間的に細胞間伝達分子の透過性が厳密に制御されていると考えられています。
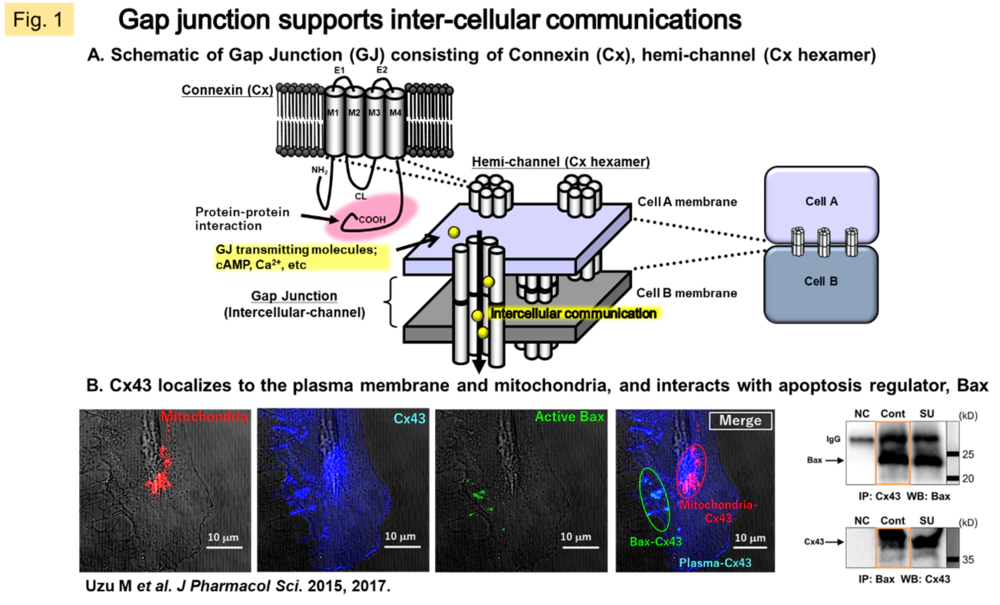
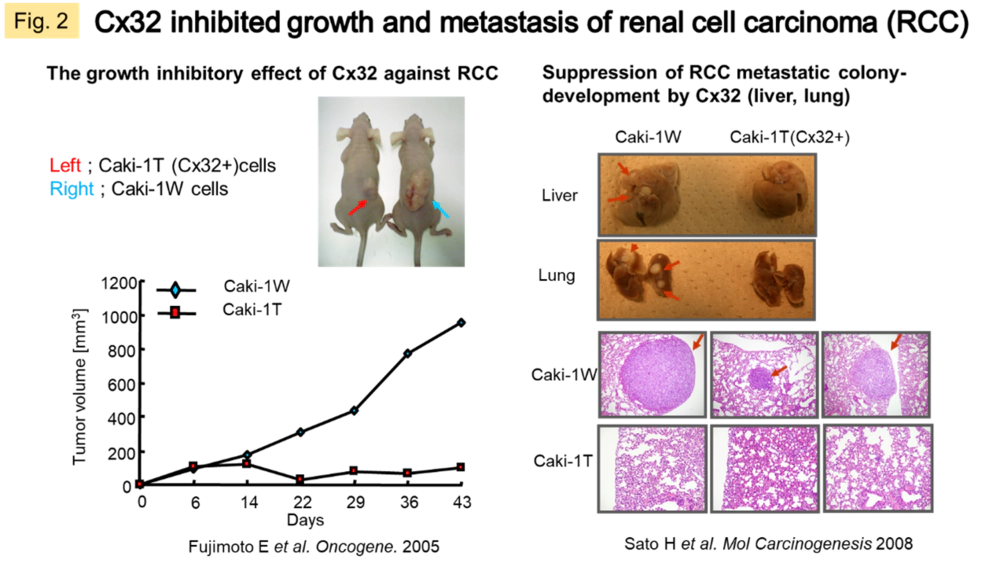
一般にCxは分化した細胞の指標となります。また、ある種の病態で変動したり、ストレスの応答因子として動いたり、疾患感受性因子となる報告も数多くあります。がん組織では多くの場合、Cxの発現や機能の低下が認められます。私たちはCx32またはCx43を肺がん、腎がん、悪性中皮腫などの固形腫瘍に遺伝子導入すると増殖の抑制,転移・浸潤能の低下,薬物感受性の向上といった現象が起こることをヒト株化細胞およびモデル動物で確認してきました(Fig. 2)。この作用機構はGJを介する組織内の情報伝達の回復、またはCxタンパク質のカルボキシ末端領域(Cx分子種によって特異的な細胞質内領域)における他のタンパク質との相互作用によると示唆されます(Fig. 1B)。近年の検討で、Cxと直接相互作用する細胞質分子を探索し(c-Src, Bax)、悪性中皮腫におけるsunitinib抵抗性に対してCx43が細胞質に局在するアポトーシス誘導因子Baxを活性化し、その後のミトコンドリア移行を促進する機構を明らかにしました。
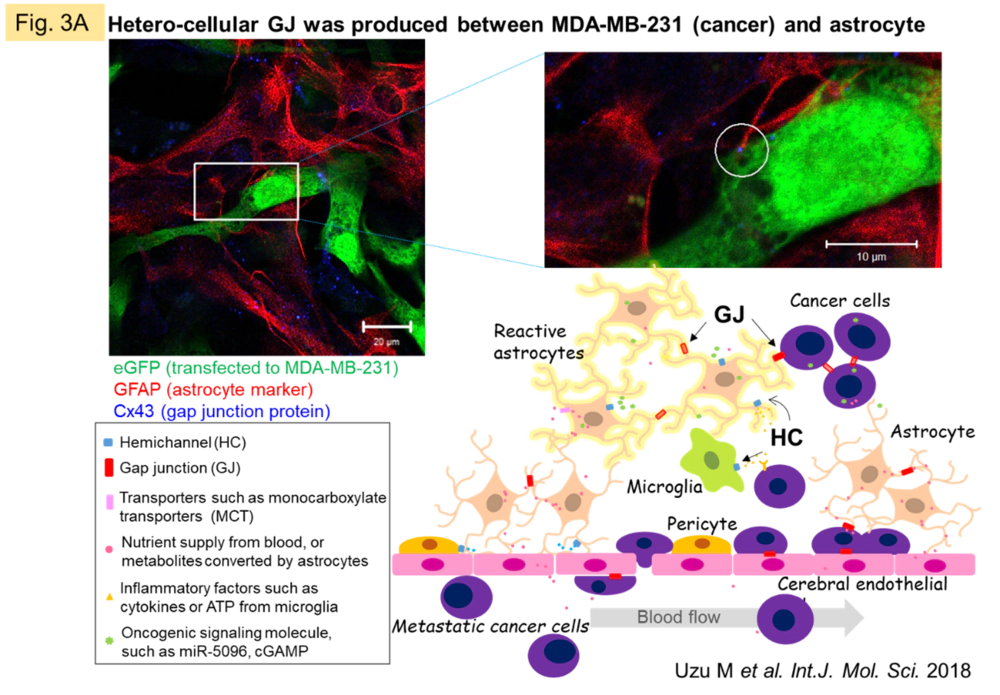
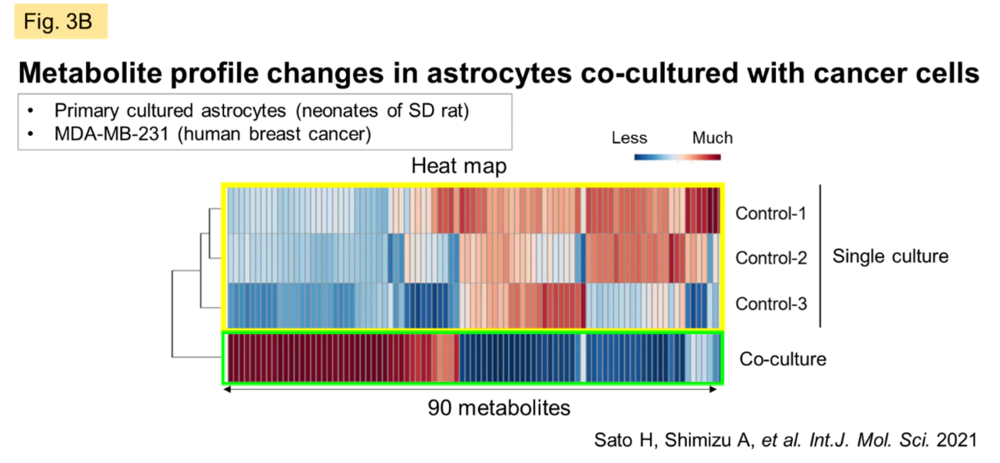
このようにCxの分子メカニズムが解明されてきたにも関わらず、生体におけるGJの本質的な意義については未だ明らかにされてません。私たちは、GJのダイナミックなネットワークを捉え、GJを透過する分子および関与する事象・病態を根気強く明らかにしていくことが、その答えに近付くと考えています。そこで最近はGJの活動性が活発で、in vitro系に持ち込んでもその活性が保持されやすい中枢神経領域(CNS)に重点を置いています。CNS全体でGJネットワークは様々な細胞間で観察されますが、脳実質の過半数を占拠するとされるグリア(神経、血管以外のCNS構成細胞)の中でも特にアストロサイトに発現が多くみられます。ある種のグリオーマ(脳原発腫瘍、神経およびグリアが悪性化したもの)では悪性度に比例してGJ機能が低下します。ところが転移性脳腫瘍では、転移がん細胞とアストロサイトの異種細胞間でGJが形成され(Fig. 3A)、がん細胞からの刺激分子の透過が両細胞間コミュニケーションの引き金となる可能性があります。がん細胞とアストロサイトを混合培養すると、アストロサイトのみを単培養した場合やがん細胞の培養上清をアストロサイトに添加培養した場合と比較し、アストロサイトの代謝プロファイルが大きく変化する様子が観測されました(Fig. 3B)。現在はこのような相互作用の実態解明に向き合っています。
代謝に着目した多層的解析によるがん薬物耐性化機構の解明
めまぐるしい増殖速度に見合うように、ときには休眠状態で生きながらえるために、がん細胞は独特のエネルギー獲得経路を発達させます。このような変化は比較的短期間で細胞の形質を変化させ、がんの増悪や治療薬を無効化する事象にも関係します。また、代謝の柔軟性にはエピジェネティック調節が関与しており、メタボロームとエピゲノムの変化は双方向性であるとも考えられています。がんの形質変化のスイッチがどこで入り、どのように制御されているのか、がん原遺伝子との関係性はどうなっているのか、また周辺細胞にどのように伝播していくのか、多階層に存在する膨大な情報の縦糸と同一層内の事象の横糸を紡いでいくことは、本質的な病態理解、そして新たな治療標的開拓の鍵になるはずです。また、各層の情報を繋ぐために、各層内・異相間のデータの相対定量化を適切に実現する仕組みも欠かせません。そのために、実験データおよび蓄積された既存の情報を組み合わせてquantitative
systems pharmacology (QSP)を実践し、がん種を超えた耐性化機構の解明を目指しています。
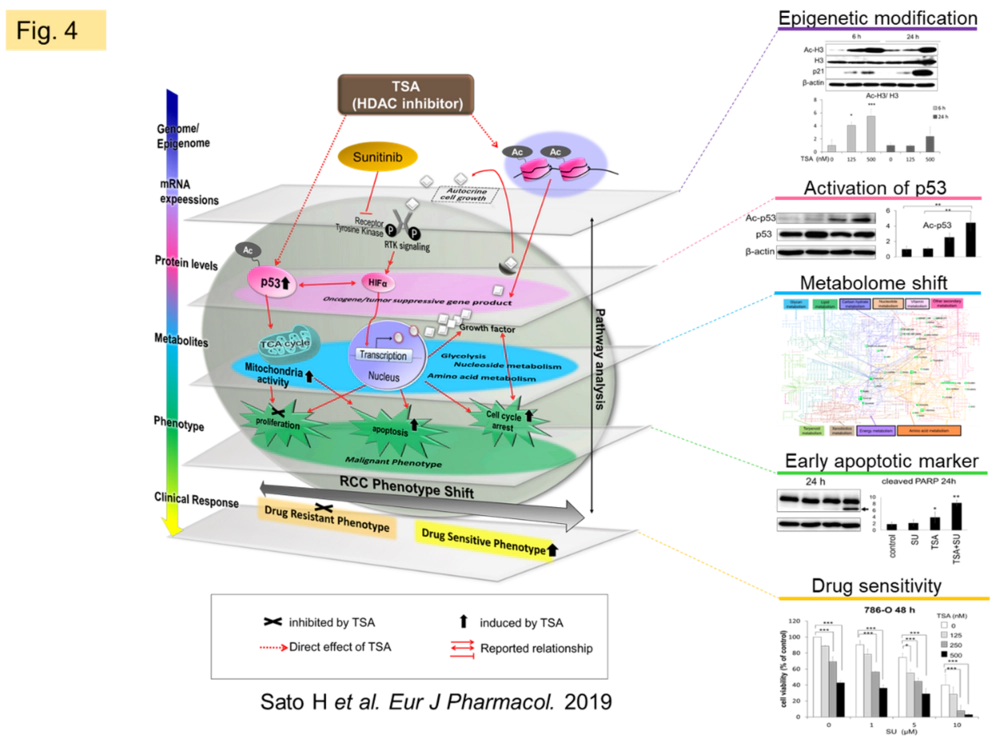
私たちはエピジェネティック調節薬の一種であるtrichostatin A
(TSA)が腎細胞がんのsunitinib感受性を向上することを確認し、TSAがよく知られたヒストン脱アセチル化酵素(HDAC)阻害活性による遺伝子調節作用に加え、代謝調節作用を有することを明らかにしました(Fig.
4)。
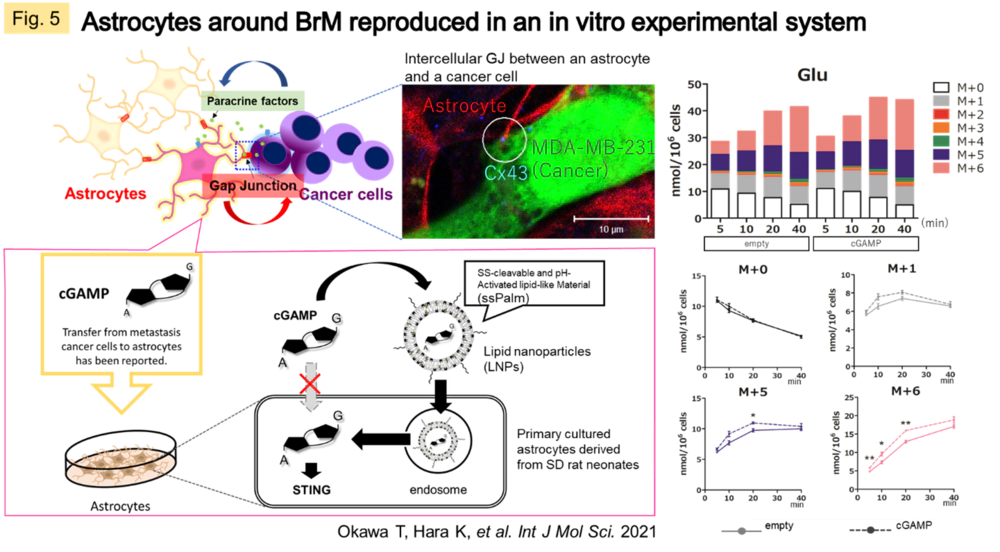
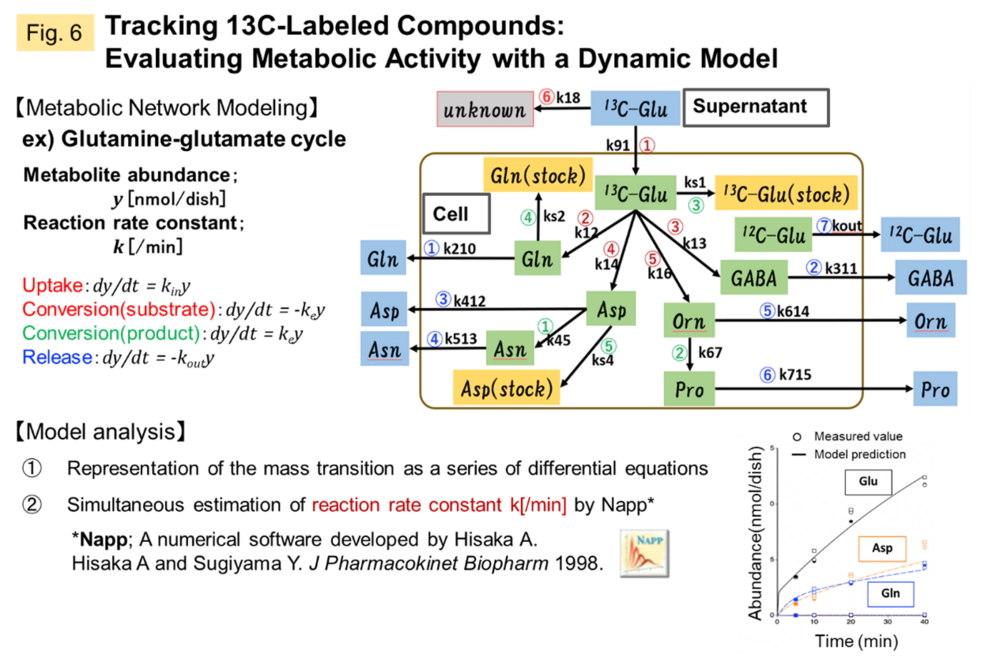
現在は転移性脳腫瘍(BrM)のがん微小環境の解明に向けて、CNSの恒常性を担うアストロサイトが接触するBrMからの刺激によって起こすメタボロームシフトを定量化すること、そしてこの情報をQSP解析へ組み込むために、がん細胞から伝達されるセカンドメッセンジャー,2’3’-cyclic GMP-AMP(cGAMP)を直接アストロサイトに導入する評価系を立ち上げ、13C標識化合物を活用した代謝活性の定量評価を行っています(Fig.5, 6)。
2. 慢性疾患における細胞間コミュニケーション:糖尿病と心不全
SGLT2阻害薬の作用点から読み解く糖尿病と虚血性心疾患の交わり
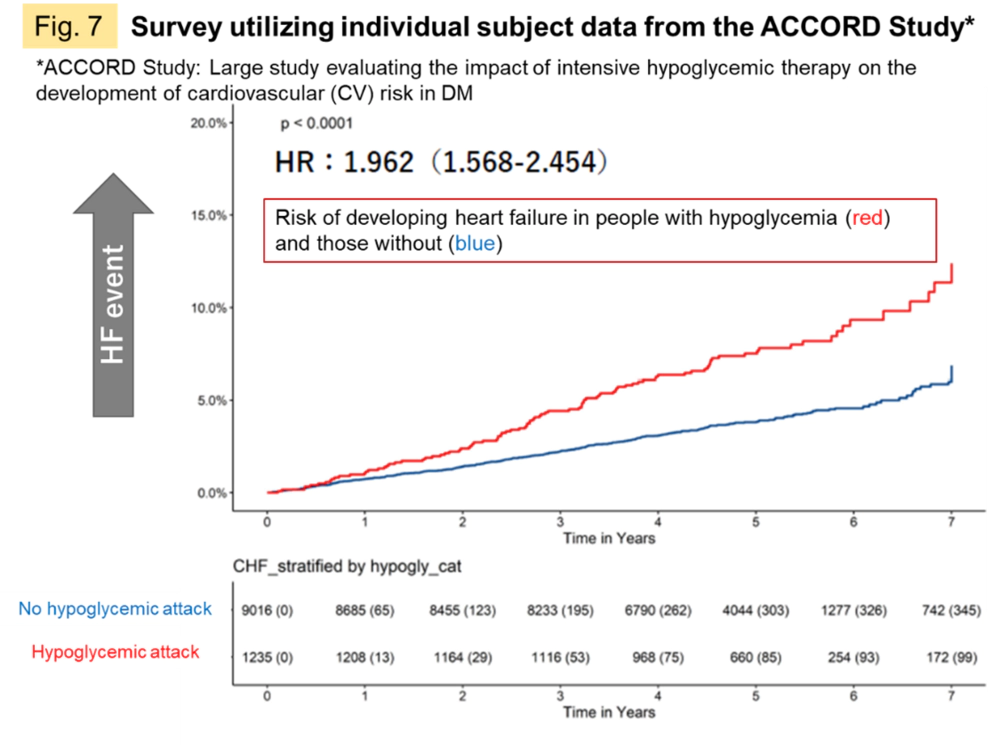
2型糖尿病(DM)の進行は生命に関わる心血管(CV)イベントの発症や慢性心不全(HF)を併発しやすくなるといわれています。HF患者では6割の方がDMの予備兆候であるインスリン抵抗性を呈しているという報告もあります。一方で、DM治療薬として開発された血糖降下薬,SGLT2阻害薬がDMのCVイベントを抑えること、HFの予防効果があること等がわかってきました。これまで別々の疾患として治療薬が開発されてきたものが、病態機構の解明によって革新的でより包括的な治療法に置き換わる可能性も期待されます。私たちは公的リポジトリから入手した臨床試験の被験者個別情報を調査し、低血糖発作という血糖値の激しい変動を経験すると心不全の発症リスクが上がる傾向を確認しており(Fig.7)、両者に共通の病態機構を示唆するものと考えています。
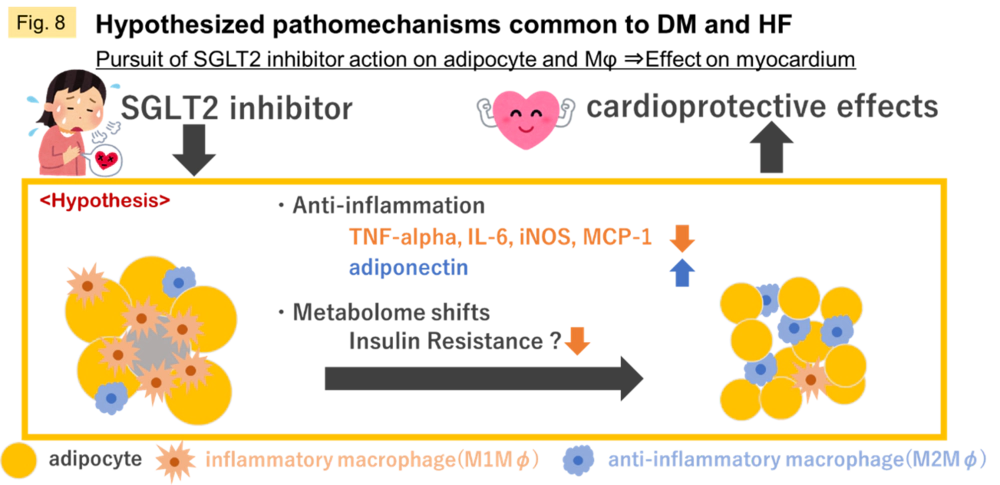
現在はDMから進行する虚血性心疾患の本態として、脂肪細胞が誘導する炎症環境、マクロファージの動員、心筋の代謝シフトなどに着目して検討を進めています(Fig.8)。
研究姿勢
細胞間に生じる相互作用、細胞内への伝達、そして発生する生理現象(形質異常)は連続的であるはずですが、技術的に捕捉できるのはその過程のほんの一部です。近年のオミクス解析の著しい進歩は網羅的に情報を採取する敷居を大幅に下げました。個々の情報は一瞬を切り取ったものであっても、集合体となれば威力は倍増です。一方で、データ駆動的に情報を繋げる解析技術、真の要因を追究する論理的思考性は今後ますます大きな意味を持つと考えます。生データを縦横斜めからじっくり咀嚼し、試行錯誤の果てに解釈を展開する過程は、苦しくも清々しいものです。常に医療を意識し、かつ自然科学の追究に謙虚に臨んでいただきたい。本研究に関わる皆様とは、何よりもおしゃべりな細胞たちとの対話を楽しみながら、自身の成長を信じ、互いに切磋琢磨していきたいと思います。