モデリング関連テーマ
研究テーマ一覧へ戻る研究内容
この20年あるいは30年の研究の進歩で、薬物速度論あるいはモデル解析の理論は生理学的薬物速度論(PBPKモデル)に集約されて完成し、その研究技術に手を加えるところはもうないと考える人が少なくありません。果たしてそうでしょうか。樋坂は自分の研究に加えて薬物相互作用や生理学的薬物速度論のガイドライン作成の経験を通じ、PBPKモデルは万能ではなく、その精度にはまだ大いに改善すべき点があると感じます。また薬物動態学のウェットの研究にはiPS細胞など新技術の波が押し寄せているのに、モデル解析はこれを十分に活用できていません。さらに薬物動態学の枠を超えて、ビッグデータを活用した薬効や安全性の解析に目を向けると、ここではまだどのような解析が可能かさえ、まだ明確とは言えないのが現状です。モデル研究の分野にはむしろ革新が必要とされていると考えます。樋坂の研究グループでは、そこで2020年現在、以下の研究を展開しています。
薬物吸収プロセスの統合的解析 (樋坂・佐藤)
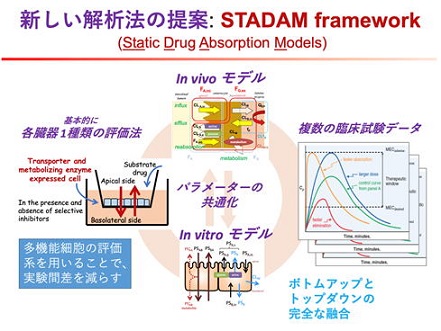
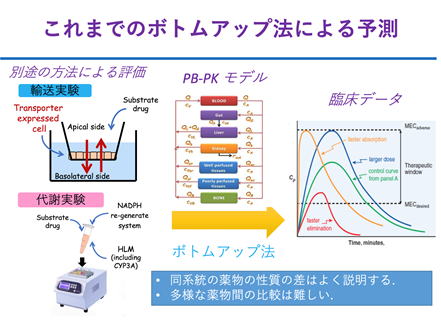
薬物吸収はADMEの中で、バラつきやすく最も予測が難しいプロセスです。これまでのPBPKモデルによる方法では、沢山の情報が必要な上に、in vitroからin vivoに積み上げるボトムアップのプロセスの途中に不明確な情報があると、途端に解析の信頼性が乏しくなりました。この欠点を克服するため、私たちは「STADAM (スターダム)」と呼ぶ新しい薬物吸収プロセスの解析のためのフレームワークを提案します。STADAMには以下の新しいアイデアがあります。
(1) In vitroとin vivoの情報を含む全てのデータを、同時にしかも完全に同等に扱って解析します。これにより特定の実験系あるいは情報源の誤差による偏りを防ぎ、また先入観を廃した客観的な解析を実現します。
(2) 多数の薬物の情報を同時に解析します。これにより薬物で共通した性質を適切に評価し、また薬物によっては情報が欠けていても適切に解析します。
(3) これまでのin vitro実験は、特定の活性のみを測定するものでしたが、in vivoの現象は多数の活性の相互作用の結果です。そこでこれまではPBPKモデル等を使って、多数のin vitro実験を組み合わせて解析していました。しかし、最近のiPS細胞などの発達で、複数の活性を同時に発現するin vitro実験系がすでに入手可能になっています。ここで生じている新たな問題は、複数活性の同時評価の技術が実はないことなのです。STADAMではモデル解析を利用して、1つのin vitro実験で複数の活性を同時に評価し、原理的に実験間のばらつきに左右されない高精度の予測を実現します。
(4) 小腸では薬物代謝とP糖蛋白等による管腔側への排出輸送が異物の吸収バリアとして働きます。また薬物代謝は肝臓でも盛んに行われます。STADAMではこれらの寄与を明確に区別し、吸収性の予測に有効に利用します。
薬物相互作用の研究 (樋坂・佐藤)
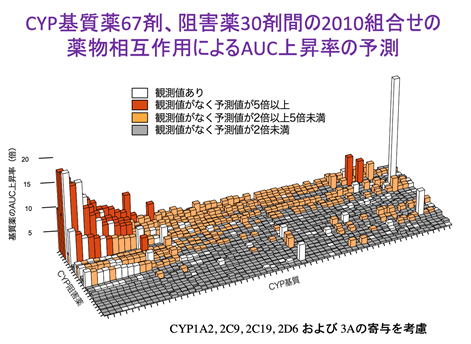
われわれは、薬物代謝酵素CYPの関与する薬物相互作用を系統的に予測し注意喚起する新しい方法「PISCS(ピスクス)」を提案し(Hisaka A et al. Clin Pharmacokinet, 2009;48:653)、この考え方はPMDAを中心として2018年に策定された「医薬品開発と適正な情報提供のための薬物相互作用ガイドライン」の基本的な考え方の1つとして取り入れられました。今後の医薬品添付文書では、CYPの阻害剤、誘導剤について分子種を明確に区別すること、またAUCの変化の程度に応じた強度で分類して管理すること、これらの方向性が示されます。PISCSは進化を続けており、以下のように2000を超える薬剤の組み合わせの血中濃度予測を実現しています。薬物相互作用の予測技術の向上に従い、その基盤となるin vitro実験の精度にも課題が多いことが明らかになってきました。私たちは細胞、ミクロソーム、動物等を用い、高感度のLC-MS/MS測定を駆使して地道な実験精度の向上にも取り組んでいます。
多彩なコンピュータ解析技術 (樋坂)
臨床薬理学研究室の研究は、薬学部としては例外的なほど多彩で高度なコンピュータ解析技術により支えられています。一般のモデル解析では非線形最小二乗法によるパラメータ最適化や連立微分方程式の数値計算、さらに臨床薬物動態学では母集団薬物速度論などの解析技術が一般に使われますが、これらはもちろん、そのほかにギブスサンプリングなどのベイズ統計学に基づくマルコフ連鎖モンテカルロ(MCMC)法、ランダムフォレスト、勾配ブースティング決定木、パーセプトロンなどによる機械学習などの様々な数値解析法が、R、SAS、MATLAB、NONMEM、WinBUGS、Stan、Pythonなどの環境で動作しています。また樋坂が開発したNappは薬物動態解析ソフトとして古くから公開されており、多数の研究者に使われています(樋坂. 薬剤学, 2011;71:168)。我々はモデリングの専門家なので、モデルの数学的性質が明確な技術を使うようにしています。MCMC法は相互作用や動態の人種差の研究に、機械学習は大規模臨床試験の解析や多様な薬剤の吸収に及ぼす食事の影響の解析に、それぞれ特性を考慮して適用しています。
SReFT(スレフト)よる慢性疾患の長期進行に関する研究 (樋坂)
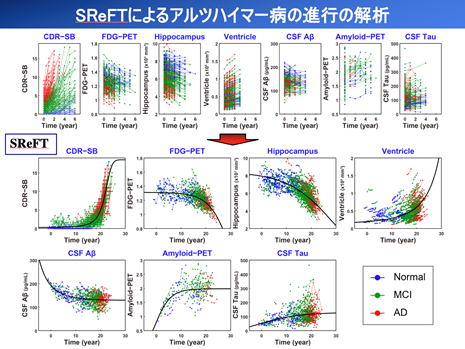
慢性疾患は罹患期間が20~30年に及ぶことが多く、高齢者の疾患の大部分を占めます。しかし臨床研究は長くても数年で、慢性疾患の全体を捉えることは困難です。我々は短期間の観察でも多数の変化の傾向を統計学的につなぎ合わせることで、長期間の推移の解析が可能と考え、SReFTと呼ぶ全く新しい解析技術を開発し、東京大学の研究グループと共同でアルツハイマー病の解析に適用しました(Ishida T et al. Clin Pharmacol Ther. 2019;105:436)。臨床薬理学研究室では、SReFTをパーキンソン病やCOPDの解析に適用して研究を進めています。SReFTは母集団薬物動態解析法を大幅に拡張したものです。疾患進行に伴う長期的なバイオマーカーの変化の推定に加えて、その変化に影響を及ぼすリスクを解析することができます。慢性疾患の原因や、どの段階の患者にどのような治療を施すべきかなどの疑問に、SReFT解析は重要なヒントを与えてくれると期待しています。
疾病と薬効のモデル解析 (樋坂・佐藤)
薬物動態の解析に比べて、疾病や薬効をコンピューターでモデル解析する研究はまだ一般的とは言えません。臨床薬理学研究室では前述のSReFTに加えて、慢性心不全、抗凝固薬、糖尿病、がん、感染症などの多様な疾病、あるいはその治療のモデリング解析に取り組んでいます。これらの研究には文献調査に基づくモデル基盤のメタアナリシス(MBMA)の他に、臨床試験の個別被験者情報の公開制度や日米の副作用データベースなどの多様な情報源が利用されています。現在、臨床薬理学研究室には複数の企業の臨床開発の社会人大学院生が在籍しており、アカデミアでは珍しく臨床試験情報のプロフェッショナルの視点からの解析を可能にしています。