研究内容
生物薬剤学研究室では、医薬品やその候補化合物の体内動態と有害作用について研究をしています。新薬の研究開発においては、人体に直接投与するという医薬品の特性上、試験管の中やマウスでの試験結果が良好でも、いざヒトに使用してみると、予期しない副作用が発生するというケースは頻発します。医薬品などの体内動態は治療効果以外の望ましくない有害作用(副作用)と密接に関連しています。中でも肝臓は生命活動に必須となるエネルギーの産生工場である一方で、生体にとって異物である医薬品などの代謝、排泄による異物解毒の中心を担っています。例えば、その異物代謝過程で生じる化学的に不安定な代謝物は、蛋白質と結合することで薬剤性肝障害(Drug induced liver injury: (DILI))を誘発することが知られています。当研究室では、このように薬物の体内動態と密接に関連する副作用が起こる機序を明らかにすることにより、安全性の高い医薬品の開発や有効な利用につながる、次のような研究テーマを進めています。
1.DILIの発現メカニズムに関する研究
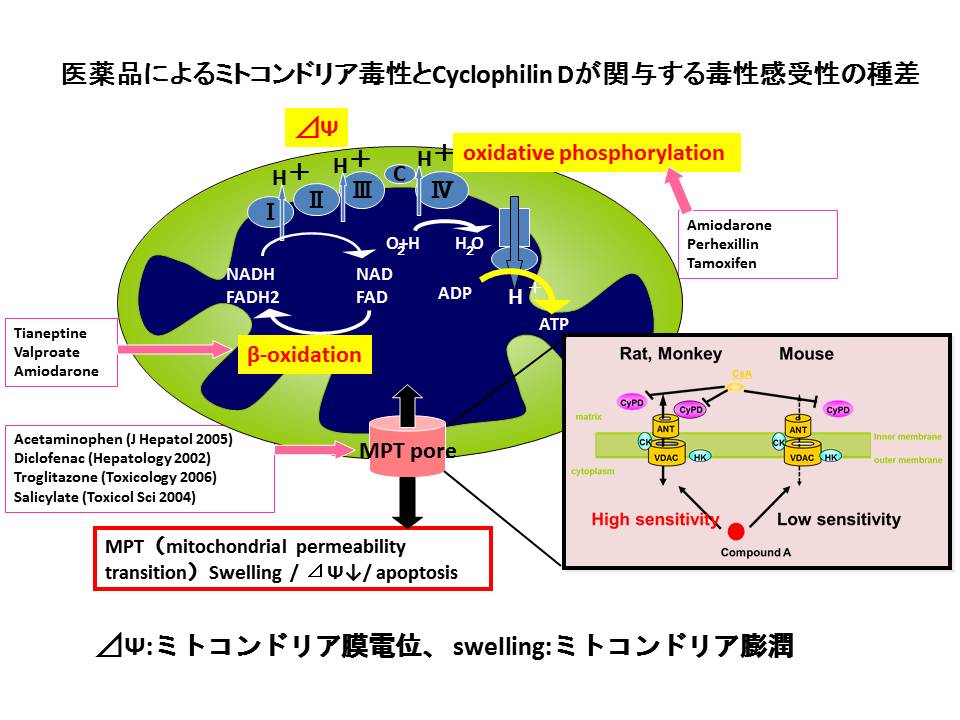
ミトコンドリアは生命活動に必須なエネルギーを産生するオルガネラです。その機能異常はアポトーシスなどを引き起こし、細胞死につながります。我々は、医薬品やその候補化合物によるミトコンドリア障害性に種差があることを見出し、これが主にミトコンドリアに発現するCyclophilin Dの発現量の違いに起因することを明らかとしました。Cyclophilin Dはミトコンドリア内のイオンのバランスを調節している蛋白質です。この発見は、医薬品開発の際にヒトでのDILIをより正しく予測するために役立つと考えています。
<公表論文>
Sekine S et al. The role of cyclophilin D in interspecies differences in susceptibility to hepatotoxic drug-induced mitochondrial injury. Biochem Pharmacol. 86(10):1507-14, (2013). (PubMed)
2.肝臓における異物排泄機構に関する研究
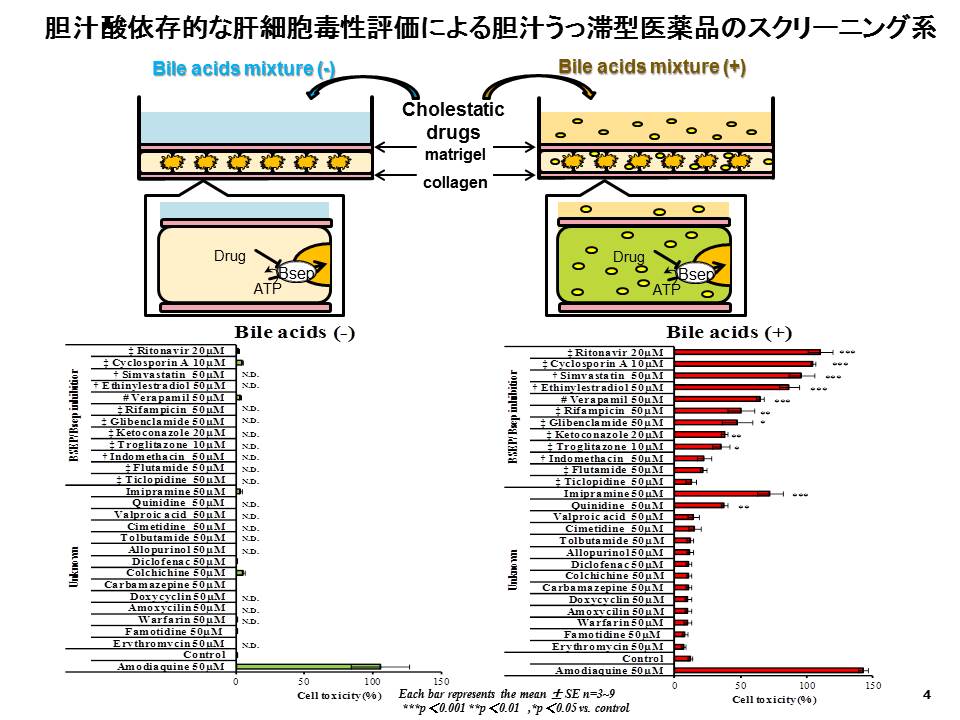
胆管側膜を介した異物、薬物の胆汁排泄機構、特に一次性能動輸送担体であるmultidrug resistance-associated protein
2 (MRP2)やBile salt export pump (BSEP)による胆汁中排泄に関して研究を行っています。これら輸送担体が薬物により阻害されると胆汁うっ滞型肝障害につながります。これまでに肝細胞に細胞外マトリクスを上層して培養するサンドイッチ培養肝細胞という培養手法において胆汁酸と被検薬物を共存させることで、通常の毒性試験では検出することのできなかった、胆汁排泄輸送担体の阻害に起因した肝細胞障害を検出することに成功しています。本手法は、胆汁うっ滞型DILIを引き起こす医薬品化合物のスクリーニング系としての有用性が認められ、特許を取得しています。
<公表論文・特許>
Ogimura E et al. Bile salt export pump inhibitors are associated with bile acid-dependent drug-induced toxicity in sandwich-cultured hepatocytes. Biochem Biophys Res Commun. 416(3-4):313-7, (2011). (PubMed)
特願2011-152087号 被験化合物の肝毒性を評価する方法および肝毒性を有する化合物のスクリーニング方法
3.オートファジーを利用したがん細胞の代謝モデュレーション
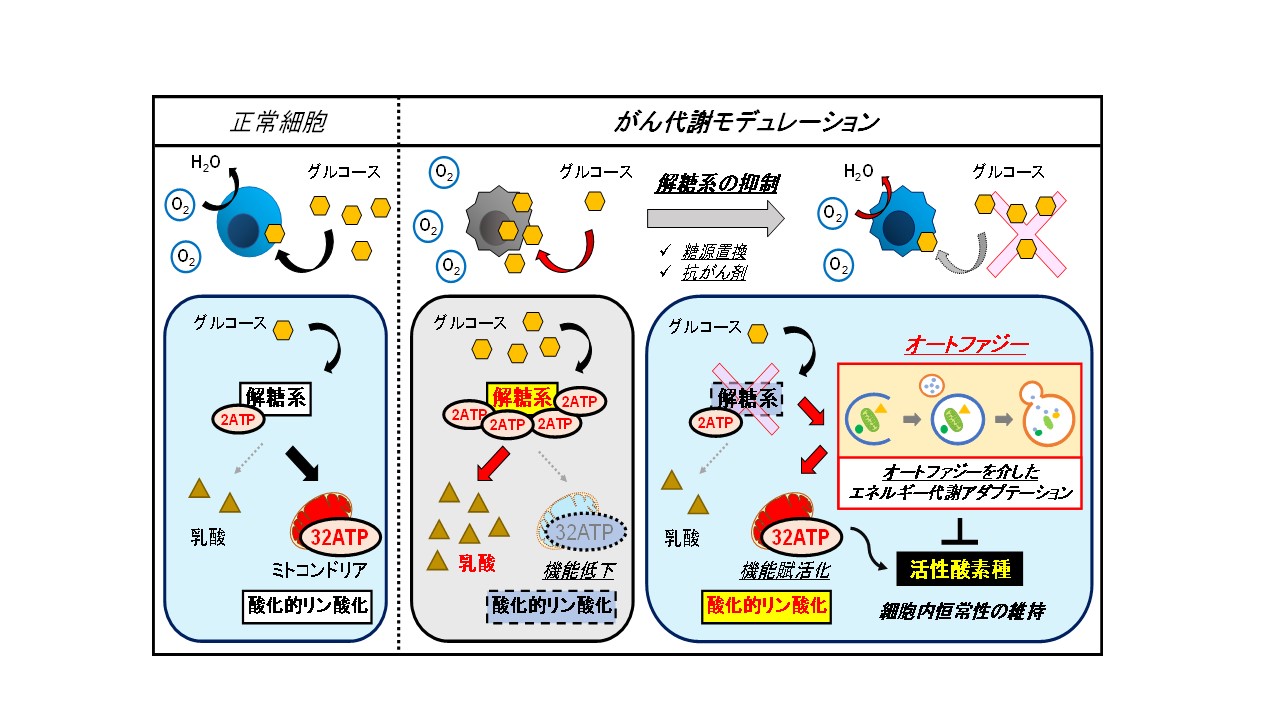
哺乳類細胞は、解糖系とミトコンドリアにおける酸化的リン酸化より生きるためのエネルギーであるATPを産生します。通常、酸素が存在する状態では、酸素を使って酸化的リン酸化よりATPを産生しますが、がん細胞では、酸素が存在しても解糖系よりATPを作る特徴的なメカニズムを有しています。しかし、がん細胞における解糖系を抑制してもがん細胞は生きながらえることができ、がん細胞はそのような環境の変化にうまく適応する能力をもっていることが近年明らかとなってきました。私たちはそのがん細胞における代謝の調節機構である“がん代謝モデュレーション”に着目して研究を進めています。 近年私たちは、がん細胞の解糖系を抑制したときに“オートファジー”が誘導されることを見出し、それがミトコンドリアによる酸化的リン酸化の駆動に重要な働きを担うことを報告しました(Kawaguchi and Aoki et al. Biochem Biophys Res Commun. 2016)。また、抗がん剤によって生じる解糖系の抑制によってもオートファジーが誘導され、それが抗がん剤の効果に影響を及ぼしていることも見出しました(Aoki and Morita et al. Oncotarget. 2017)。 オートファジーは2016年のノーベル賞の受賞対象にもなった、細胞内のタンパク質や小器官(オルガネラ)の分解機構です。オートファジーは不良なタンパク質を分解する“ごみの処理機構”として働いているだけでしょうか?私たちは、オートファジーが細胞内の品質管理を行い、恒常性の維持に重要な役割を担っていると考えており、がん細胞においては、解糖系の抑制によるエネルギー(ATP)の不足を補うためにオートファジーを亢進させて、うまく環境に適応していると捉えています。 私たちが発見した知見は、解糖系の抑制とオートファジーの阻害の組み合わせによるがん治療の戦略の有用性を示唆するものだけではなく、がん細胞のエネルギー代謝を標的とした治療の発展に役立つと考えています。今後、解糖系を抑制したときにどのようなメカニズムでオートファジーが誘導されてくるのか、オートファジーによる細胞内の品質管理機構、特にミトコンドリアの機能調節機構はどのようなものかを詳細に検討していく予定です。
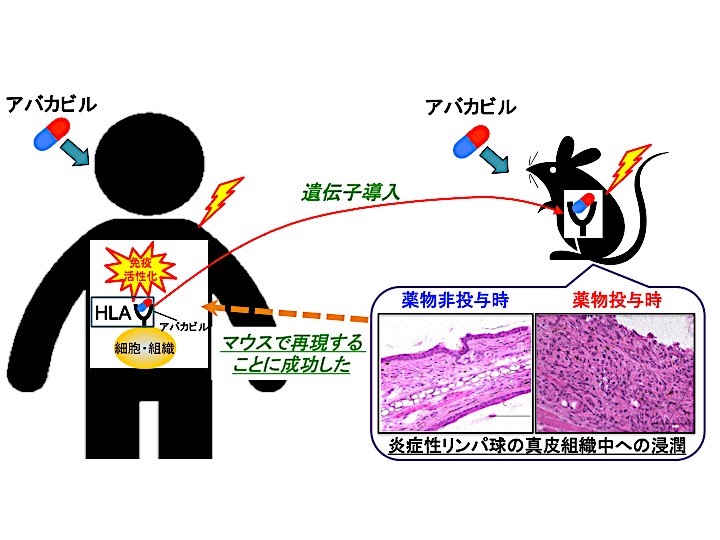
4. 「医薬品による副作用の個人差」の解明を目指した研究
医薬品による副作用にはある特定の体質(遺伝子)・環境により現れる個人差が関係すると考えられており、中には死亡例も報告されています。これらの可能性を医薬品の開発段階で見出すことは極めて困難とされており、市販後、臨床で広く使用されて初めて明らかとなることが大きな問題となっています。これまで多くの研究者が様々な動物モデルを用いた検討を試みてきましたが、成功した例は未だかつてありませんでした。そこで、当研究室では特定のヒト白血球抗原(HLA; 注)を遺伝子導入したモデルマウスを作製し、HLAが発症に関わる「副作用の個人差」の詳細なメカニズムや組織特異性を検証する研究を行っています。一例として、これまでに抗HIV(ヒト免疫不全ウイルス)薬であるアバカビルとHLA-B*57:01遺伝子タイプとの相互作用により起こる副作用(皮膚障害を含む過敏症)を本モデルで再現できることを世界で初めて実証しております(Susukida et al., Arch Toxicol. 2017; 下図)。私たちが発案した動物モデルのコンセプトを今後応用することで、医薬品の副作用がどのような仕組みで起こるのかを解明することに繋がり、より安全な医薬品を提供できるようになることが期待されます。 注)HLA: ヒト白血球抗原と呼ばれ、「自己」を特徴付ける細胞表面のタンパク質のこと。体内で「自己・非自己」を認識するための重要な免疫機構として働き、侵入した異物(非自己)を免疫機能により排除することで、自己の恒常性を維持している。